Цілі уроку: розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі властивостей середніх солей; розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей середніх солей. Тип уроку: поглиблення й систематизація знань. Форми роботи: розповідь учителя, демонстраційний експеримент, робота з опорною схемою. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, розчини реактивів.
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання
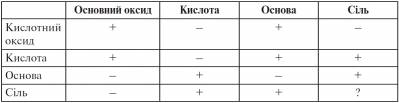
ІІІ. Мотивація навчальної діяльності Ми вивчили хімічні властивості оксидів, кислот, основ. За результатами наших досліджень ми склали таблицю взаємодії класів неорганічних сполук. Звернімося до цієї таблиці.
З допомогою цієї таблиці й демонстраційного експерименту складемо план вивчення хімічних властивостей солей: Солі взаємодіють: 1) з кислотами; 2) з основами; 3) із солями.
Ø Якщо утворюється нерозчинна речовина; Ø якщо виділяється газоподібна речовина; Ø якщо утворюється вода. Розглянемо властивості солей експериментально.
IV. Демонстрація 10. Хімічні властивості солей
Дослід 1. Взаємодія солей з кислотами Цю властивість кислот ми вивчали. В якому випадку можлива ця реакція? (Якщо знову утворена кислота слабша за кислоту, що реагувала) До розчину натрій карбонату додаємо кілька крапель сульфатної кислоти: K2CO3+H2SO4=K2SO4+H2O +CO2↑ Ознака реакції — виділення газоподібної речовини. Карбонатна кислота, що утворилася, слабша за сульфатну. Висновок. Солі реагують із кислотами, якщо кислота, яка утворилася, слабша за ту кислоту, що реагувала.
Дослід 2. Взаємодія солей з основами Ці реакції ми розглядали, вивчаючи властивості лугів. - Які речовини при цьому утворювалися? (Нерозчинні основи) До розчину алюміній сульфату по краплях додаємо натрій гідроксид. Al2(SO4)3+6NaOH= 2Al(OH)3+3Na2SO4 Висновок. Солі взаємодіють з основами, якщо утворюється нерозчинна сіль або основа.
Дослід 3. Візьмемо дві солі. До натрій сульфату додамо барій хлорид. Спостерігаємо випадіння осаду, отже, відбулася хімічна реакція. BaCl2+Na2SO4=BaSO4↓+NaCl2 Звернімося до таблиці розчинності: BaSO4 — нерозчинна сіль. До натрій сульфату додамо калій карбонат. Видимих ознак реакції немає. Запишемо рівняння реакції: Na2SO4 (розч.)+ K2CO3 (розч.) =K2SO4 (розч.) + Na2CO3 (розч.) Подивіться в таблиці розчинності. Всі солі розчинні, реакція не протікає. Висновок. Солі взаємодіють між собою, якщо в результаті реакції утворюється нерозчинна сіль. Додаємо «плюс» у таблицю.
Дослід 4. Крім перелічених властивостей солі можуть взаємодіяти з металами. Розглянемо дві пробірки. У першу наливаємо розчин купрум (ІІ) сульфату й кидаємо дві гранули цинку. У другу наливаємо розчин цинк сульфату й кидаємо два шматки мідного дроту. Спостерігаємо за обома пробірками. Що відбулося в першій? (На шматочках цинку з’явився червоний наліт міді) У другій пробірці змін немає. Звернімося до ряду активності металів. Така реакція можлива, якщо метал, який додається, активніший за той, що входить до складу солі. Запишемо рівняння реакції: CuSO4+Zn= Cu+ZnSO4 Cu + ZnSO4 ≠
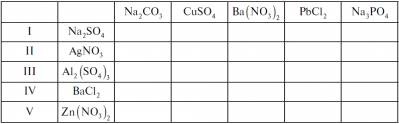
V. Керована практика Завдання 1 Учень заради експерименту занурив шматочки металу в розчини кислот. Поясніть, що спостерігатиме учень у кожній пробірці, і підтвердьте свої припущення рівняннями хімічних реакцій: а) Mg +H2SO4→ б) Ag +HCl→ в) Al + H2SO4→ г) Ca +HCl→ д) Ag + H2SO3→ е) Cu + H2SO4→ ж) Zn +H3PO4→ з) Hg +H2CO3→ Завдання 2 Складіть рівняння можливих реакцій за таблицею: VI. Домашнє завдання Опрацювати відповідний параграф підручника, відповісти на запитання. Закінчити роботу із завдання 2. Творче завдання. Підготувати повідомлення про поширення солей у природі та їх практичне значення. | |
Схожі матеріали: |
| Всього коментарів: 0 | |