Цілі уроку: ознайомити учнів з фізичними й хімічними властивостями кислот; розширити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот, їх узаємодії з металами, основними оксидами, основами й солями; розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей кислот. Тип уроку: вивчення нового матеріалу. Форми роботи: розповідь учителя, демонстраційний експеримент, лабораторні досліди, робота з опорною схемою. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, хімічні реактиви.
ХІД УРОКУ
І. Організація класу
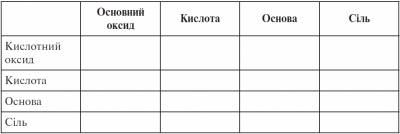
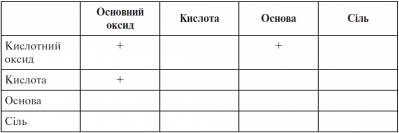
ІІ. Перевірка домашнього завдання, актуалізація опорних знань На попередніх уроках ми познайомилися з фізичними й хімічними властивостями оксидів. - З якими класами неорганічних речовин узаємодіють оксиди? (З водою, з лугами — кислотні оксиди, з кислотами — основні оксиди, з іншими оксидами) Розставте знак «плюс» там, реакція можлива, виходячи з властивостей оксидів.
- А як же інші клітинки? Щоб заповнити їх, ми повинні вивчити хімічні властивості інших класів неорганічних сполук.
ІІІ. Вивчення нового матеріалу Фізичні й хімічні властивості кислот Коли ми вивчали класифікацію кислот, звернули увагу, що більшість відомих кислот — це водні розчини. Без води їх властивості змінюються. Наприклад, безводна сульфатна кислота не взаємодіє із залізом, що дозволяє перевозити її в сталевих цистернах. А розчин цієї кислоти розчинить цистерну дорогою. Безводна хлоридна кислота — це газ гідроген-хлорид. А в разі розчинення у воді — це хлоридна кислота, що входить до складу шлункового соку. Вивчення хімічних властивостей кислот ми проведемо за планом:
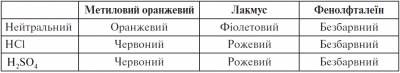
1) Лабораторна робота № 1. Дія кислот на індикатори Для проведення цієї лабораторної роботи ми використаємо пластинку для мікрометоду. Акуратно капаємо в перший ряд по дві краплі хлоридної кислоти, у другий ряд — по дві краплі сульфатної кислоти. Далі в перше заглиблення з кислотами додаємо одну краплю метилового оранжевого, у друге — одну краплю лакмусу, у третє — одну краплю фенолфталеїну. На підставі спостережень заповнюємо таблицю.
Висновок. У розчинах кислот метиловий оранжевий набуває черво-ного забарвлення, лакмус — рожевого. Отже, розчини кислот можна визначити з допомогою індикатора метилоранжу або лакмусу. 2) Демонстрація 4 Розглянемо, як узаємодіють кислоти з металами. Для експерименту в три пробірки наливаємо хлоридну кислоту; у першу додаємо шматочки мідного дроту, у другу - гранули цинку, у третю - магнієву стружку. - Чому метали неоднаково реагують із кислотою? Це пов’язано з властивостями металів. М. М. Бекетов розташував метали відповідно до їх активності в ряд від найсильніших до найслабших. Цей ряд так і називається — ряд активності металів. (Розглядаємо таблицю, знаходимо ряд активності металів у підручнику.) Водень серед металівперебуває не випадково. Він розділяє метали на активні, які витісняютьводень із розчинів кислот, і ті, що не взаємодіють із розчинами кислот і водень не витісняють. Запишемо рівняння реакцій: Cu +HCl ≠ Zn + 2HCl→ZnCl +2H2 Mg + 2HCl→MgCl +2H2 Укажіть тип реакції. (Реакція заміщення) Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів, наприклад: Zn + 4HNO3→Zn(NO3)2+ 2H2O+ 2NO2 3) Із попередніх уроків ми знаємо, що кислоти можуть реагувати тільки з якими оксидами? (З основними) Насиплемо в пробірку кальцій оксид, додамо розчин хлоридної кислоти. Що спостерігаємо? (Оксид розчинився) Запишемо рівняння реакції: CaO + 2HCl→CaCl2+H2O Укажіть тип реакції. Це реакція обміну — дві складні речовини обмінюються своїми складовими. 4) У пробірку наливаємо натрій гідроксид, додаємо кілька крапель фенолфталеїну — розчин забарвлюється в малиновий колір. Потім по краплях додаємо хлоридну кислоту. Яку ознаку реакції спостерігаємо?(Знебарвлення розчину) Запишемо рівняння хімічної реакції: NaOH+HCl = NaCl +H2O - Чому знебарвлюється розчин? (Середовище стало нейтральним) Укажіть тип реакції. (Реакція обміну) Така реакція між розчинами кислот і основ називається реакцією нейтралізації. Поясніть, чому. Висновок. Кислоти взаємодіють із солями. 5) Кислоти можуть витісняти більш слабкі кислоти з їхніх солей. Здійснимо реакцію, яку вам доводилося спостерігати багато разів, коли мама гасила оцтом соду. Наливаємо в пробірку розчин натрій карбонату й додаємо кілька крапель хлоридної кислоти. З’являються бульбашки газу — ознака протікання хімічної реакції. Запишемо рівняння: Na2CO3 + 2HCl→2NaCl + H2CO3 H2CO3→H2O +CO2↑
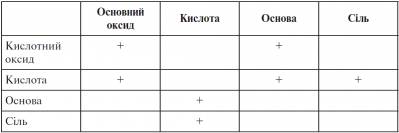
IV. Закріплення вивченого матеріалу Підіб’ємо підсумки сьогоднішнього уроку. Візьміть таблицю, яку ми почали заповнювати на початку уроку. - В які ще клітинки ми можемо поставити знак «плюс»? Взаємозв’язок між класами неорганічних сполук
Вклейте таблицю в зошит, ми доповнимо її на наступному уроці.
V. Домашнє завдання Опрацювати відповідний параграф підручника, відповісти на запитання до нього, виконати вправи. Творче завдання. Скласти правила роботи з кислотами. Таблиця до уроку 18 Взаємозв’язок між класами неорганічних сполук
| |
Схожі матеріали: |
| Всього коментарів: 0 | |