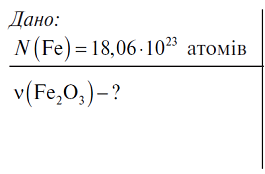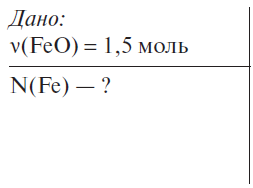Цілі уроку: увести поняття «молярна маса»; ознайомити з одиницею вимірювання молярної маси речовини; показати фізичний зміст молярної маси речовини; пояснити взаємозв’язок між кількістю речовини, масою, молярною масою. Тип уроку: комбінований. Форми роботи: керована практика, самостійна робота. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання Керована практика. Розв’язання задач Задача 1
Задача 2
ІІІ. Вивчення нового матеріалу Скільки важить 1 моль речовини? В 1 моль міститься 6,02·1023 частинок речовини. Кожна частинка має певну масу. Молярна маса — це маса 1 моль речовини, а отже, сумарна маса всіх частинок, що входять в 1 моль цієї речовини. Молярна маса пропорційна масі однієї молекули певної речовини. Тому числове значення молярної маси дорівнює відносній молекулярній масі для будь-якої речовини. Молярна маса — це фізична величина, що дорівнює відношенню маси речовини до відповідної кількості речовини. Позначається Mm
Одиниці вимірювання: Наприклад, маса 1 моль води дорівнює: Mr (H2O) = 18 а.о.м.; IV. Закріплення вивченого матеріалу Знаючи масу речовини, ми можемо обчислити кількість речовини за формулою Задача 1 Обчисліть кількість речовини кисню в 64 г кисню.
Задача 2 Обчисліть масу 3 моль карбон (IV) оксиду.
V. Самостійна робота з узаємоперевіркою Обчисліть масу 5 моль: варіант І: натрій хлориду NaСl; варіант ІІ: кальцій оксиду СаО. Після виконання завдання учні обмінюються роботами й перевіряють один одного.
VI. Домашнє завдання Опрацювати відповідний параграф підручника, відповісти на питання, виконати вправи. Творче завдання (домашня практика) 1. Обчисліть кількість речовини питної соди — натрій гідрогенкарбонату NaHCO3 в ложці соди масою 42 г. 2. Обчисліть масу 5 моль цукру (сахароза має формулу C12H22O11). | |
Схожі матеріали: |
| Всього коментарів: 0 | |