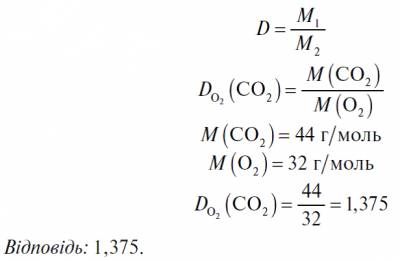Цілі уроку: розкрити суть поняття «відносна густина газів»; навчити учнів здійснювати розрахунки відносної густини газів, обчислення молярної маси за відомою відносною густиною; показати практичне значення цих розрахунків. Тип уроку: засвоєння нових знань. Форми роботи: розповідь учителя, керована практика, самостійна робота. Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, терези, колба об’ємом 0,250 мл із пробкою, установка для одержання кисню, картки із завданнями.
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання, актуалізація опорних знань 1. Звіряємо відповіді в задачах, коментуємо, відповідаємо на запитання учнів. 2. Заповнюємо таблицю на дошці й у зошитах, проводячи розрахунки усно (умови нормальні). Формули для розрахунку записуємо на дошці:
Яким законом ми скористалися, щоб обчислити об’єм газів? (Законом Авогадро)
ІІІ. Виклад нового матеріалу Розповідь учителя З таблиці на дошці видно, що однакова кількість речовини різних газів займає однаковий об’єм, але має різну масу, як і різну молярну масу. Тобто гази мають різну густину. Порівняємо густину двох газів кількістю речовини 1 моль за н. у. Тоді співвідношення густин: Таке співвідношення називають відносною густиною газів і позначають D. Це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший.
Отже, за молярною масою відомого газу можна визначити густину будь-якого газу. Демонстрація 1. Зважуємо закриту колбу з повітрям на терезах. 2. Заповнюємо колбу киснем, закорковуємо та зважуємо. 3. Обчислюємо співвідношення маси колби з повітрям і киснем, це й буде відносна густина, оскільки об’єм колби однаковий, а отже, і кількість речовин однакова. 4. M2 (O2) = 32 г/моль. За формулою
IV. Закріплення вивченого матеріалу Керована практика Задача 1 Обчисліть відносну густину карбон (IV) оксиду за киснем. Розв’язання
Задача 2 Обчисліть відносну густину сульфур (ІV) оксиду SO2 за воднем H2. (Відповідь: 32) Задача 3 Густина невідомого оксиду Нітрогену за воднем дорівнює 38. Обчисліть молярну масу цього оксиду, визначте його формулу.
Задача 4 Густина метану за гелієм дорівнює 4. Обчисліть молярну масу метану й виведіть його формулу. (Відповідь: 16 г/моль; CH4) Задача 5 Обчисліть об’єм водню, що взаємодіє з киснем об’ємом 3 л.
Задача 6 Обчисліть об’єм хлору, що вступив у реакцію з воднем об’ємом 7 л. (Відповідь: 7 л)
V. Домашнє завдання Опрацювати відповідний параграф підручника, відповісти на запитання. Творче завдання (домашня практика). Самостійно розв’язати задачі. Використовуючи знання про газоподібні речовини, скласти й розв’язати задачі, аналогічні задачі 2. | ||||||||||||||||||||||||||||||||||||
Схожі матеріали: | ||||||||||||||||||||||||||||||||||||
| Всього коментарів: 0 | |